
在合成生物学与生命起源研究中,构建“人工细胞”难度大,复合凝聚体因富集生物分子、加速反应等特性成为核心模型,但无膜凝聚体容易合并融合,且精准性和可控性差,膜化策略可提高凝聚体稳定性,但其动态性又受到限制。
近日,北京师范大学曹玮教授团队在国际权威期刊《德国应用化学》(Angewandte Chemie International Edition)发表重要成果。该研究设计了一种放疗射线响应的、可精准调控活细胞内酶反应速率的“智能凝聚体”。
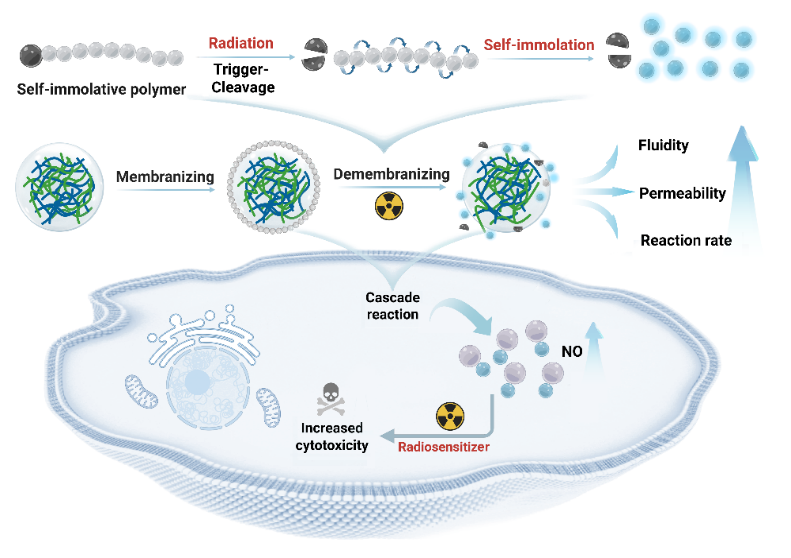
本课题中凝聚体外面裹着一层用 “自降解聚合物”(SIP)做的 “保护膜”。正常条件下这层膜异常稳定:不管是遇到浓度超高的盐(相当于海水盐度好几倍)、酸碱性波动(从偏酸到偏碱都不怕),还是被细胞培养液稀释 30 倍,它都能保持稳定。只要用临床治疗常用的射线照一下,“保护膜”就会像多米诺骨牌一样破碎。膜的破碎使得凝聚体恢复原有的流动性、融合性,进而让封装在不同凝聚体中的酶“相遇”。辐照前:两种酶远距离合作-催化速率较慢;辐照后:两种酶近距离合作-催化速率较快,实现了放疗精准调控生物催化效果。

该研究首次实现了辐射响应型凝聚体的可控脱膜,为动态生物材料的设计提供了新思路。其创新价值不仅在于解决了传统凝聚体的稳定性难题,更建立了辐射与生物化学反应之间的精准调控桥梁。γ-射线具有独特的组织穿透能力、时空可控性和强电离能力,该辐射响应性凝聚体为放化疗结合的抗癌治疗提供了全新平台。
该研究成果近期发表于Angewandte Chemie International Edition 期刊,题目为“Radiation-Responsive Coacervates Through Controlled Self-Immolative Demembranization”(//doi.org/10.1002/anie.202519473)。通讯作者为bet365体育-bet365亚洲官网 曹玮教授,bet365体育-bet365亚洲官网 为唯一通讯单位。论文第一作者为北京师范大学2023级博士研究生刘丽霞,本研究获得高技术中心重点研发计划、国家自然科学基金、北京师范大学等资助。特此感谢!


